건강사회를위한약사회(이하 건약)는 최종윤 의원이 대표발의한 ‘약사법 일부개정법률안’ 및 ‘첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률(이하 첨단재생바이오법) 일부개정법률안’에 대해 의견서를 제출하였다. 2건의 개정법률안은 조건부로 허가된 의약품 및 첨단바이오의약품을 검증하기 위한 자료 제출 의무를 강화하고, 제약사가 자료 제출기간을 부득이하게 연장하는 경우 중앙약사심의위원회 등 공식적인 전문가 자문회의를 통해 연장여부를 결정하라는 내용을 담고 있다. 건약은 충분히 검증되지 않은 의약품의 신속한 접근만으로는 환자에 대한 치료기회를 확대할 수 없음에 공감하며, 식품의약품안전처(이하 식약처)가 신속하면서도 철저하게 조건부 허가 의약품을 검증할 수 있도록 개발 회사에게 자료를 요구할 수 있게 하는 이번 개정법률안들에 찬성하였다.
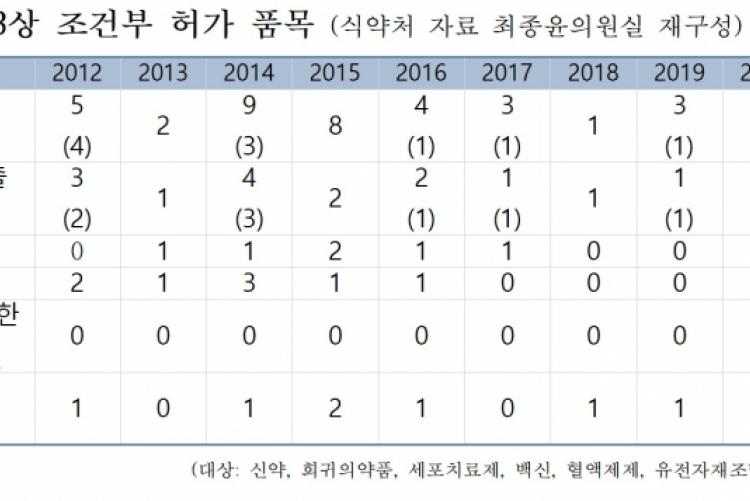
국제적인 의학학술지인 BMJ의 연구에 따르면, 미국 식품의약국(FDA)에서 가속승인(한국의 조건부 허가)를 통해 허가된 253개 의약품을 전수 조사한 결과 절반에 가까운 112개 약물이 임상효과 검증을 받지 못할 정도로 조건부 허가 제도가 본래 취지와 다르게 악용되고 있다고 분석하였다. 지난해 최종윤의원실이 분석한 결과도 크게 다르지 않았다. 2012년부터 2019년까지 조건부 허가 의약품 35품목을 전수 조사한 결과, 15품목이 3상 임상시험 자료를 제출하지 못하였고, 국내에서 개발된 의약품으로 한정하면 10품목 중 8품목이 자료를 제출하지 못하고 있었다. 2012년 허가된 ‘큐피스템’과 ‘헌터라제’, 2014년 ‘파바갈 주’ 모두 허가된 지 10년 가까이 지났지만 여전히 3상 임상시험 자료를 제출하지 않고 있었다.
또한, 자료 제출기간을 연장한 의약품은 8품목이었는데, 단 2품목만 추후에 3상자료를 제출한 것으로 나타났다. 나머지 6품목은 6∼10년이라는 기간동안에도 자료를 제출하지 않았음에도 여전히 허가를 유지하고 있었다. 심지어 제출기간을 연장한 8품목 모두 기간을 연장하면서 중앙약사심의위원회와 같은 공개적인 전문가 자문회의를 거치지 않았다. 조건부 허가 의약품 대부분은 심사과정에서 식약처의 요청으로 공식적인 전문가 자문회의를 개최함에도 제출기간을 연장여부를 결정하는 과정에서는 자문을 진행하지 않은 것이다.
현행 조건부 허가 제도는 3상 임상시험을 제출하지 않은 채 허가만 유지하는 의약품을 양산하고 있다. 하지만, 이번 개정법률안이 통과되면 제약회사는 조건부 허가 승인 후 일정기간 이내에 의약품의 3상 임상시험 계획을 제출해야 한다. 그리고 제출기간 내에도 정기적으로 이행상황을 보고해야 하며, 부득이하게 제출기간을 지키지 못할 경우 반드시 공식적인 전문가 자문회의를 거쳐야 한다. 현행 조건부 허가 제도는 그동안 부실 의약품, 가짜 제약회사를 양산하는 제도로 악용되어 왔다. 국회는 조속하게 이번 개정법률안을 통과시켜 제도의 본래 취지였던 생명이 위급한 질환이거나 신약개발이 신속하게 이뤄지기 어려운 희귀질환 환자의 치료 기회를 확대하는 취지를 살려 나가야 할 것이다.
2023년 6월 8일
건강사회를위한약사회
(첨부1) 「약사법」 일부개정법률(안) 에 대한 의견서 (건강사회를위한약사회)
(첨부2) 「약사법」 일부개정법률(안) 에 대한 의견서 (건강사회를위한약사회)